|
Опыт 1.
Получение
кислорода в
лаборатории
и заполнение
им газометра
Кислород
получают
разложением
перманганата
калия: 2KMnO4
R
K2MnO4 +
MnO2 +O2
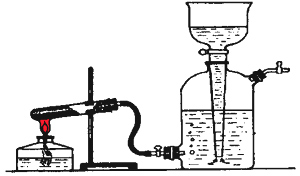 |
Прибор для
получения
кислорода
состоит из
пробирки и
газоотводной
трубки,
соединенной
с нижним
тубулусом
газометра.
Чтобы в
газометр не
попадали
частицы
перманганата
калия (вода
окрасится), в
пробирку у
пробки
помещают
ватный
тампон. Вата
не должна
соприкасаться
с солью. |
|

|
Порядок
заполнения
газометра
кислородом:
Газометр
заполните
водой,
полностью
вытеснив
воздух.
-
К нижнему
тубулусу с
краном
присоедините
прибор для
получения
кислорода.
-
Кран
верхнего (газового)
тубулуса
газометра
должен быть
закрыт;
откройте
краны
воронки и нижнего
тубулуса.
-
Нагревайте
пробирку с
перманганатом
калия,
начиная от ее
донышка.
-
Кислород
поступает в
газометр,
вытесняя
воду в
воронку.
-
Избыток воды
из воронки
вычерпывается
стаканом.
|

|
C
другими
способами
заполнения
газометра
кислородом
познакомьтесь
по "Практикуму" и
статье С.В.
Дьяковича (см.
список литературы).
 Получение кислорода,
заполнение газометра Получение кислорода,
заполнение газометра
|
Опыт 2.
Заполнение
газометра
кислородом
вытеснением
из
кислородной
подушки.
Экономически
выгоднее для
демонстрационных
опытов
использовать
готовый
кислород,
который
можно
приобрести в
аптеке,
получить у
газосварщиков,
заполнив
газом
кислородную
подушку. Для
заполнения
газометра
кислородом
подушку
присоедините
к нижнему
тубулусу и,
открыв кран,
сильно
надавите на
нее. Кислород
заполнит
газометр,
вытеснив
воду в
воронку (кран
воронки
должен быть
открыт, а
газовый кран
- закрыт).
Вычислите
по уравнению
реакции,
какой объем
кислорода (при
нормальных
условиях)
можно
получить
разложением
100 г
перманганата
калия.
 Какой
вывод можно
сделать об
экономической
эффективности
получения
кислорода из
этой соли? Какой
вывод можно
сделать об
экономической
эффективности
получения
кислорода из
этой соли?
Опыт 3.
Сжигание в
кислороде
серы
-
Заполните
кислородом
колбу
емкостью 250-300
мл.
Заполнение
проверьте
тлеющей
лучиной,
поднеся ее к
краю сосуда.
Прикройте
колбу
стеклянной
пластинкой.
-
В железную
ложку
поместите
кусочек серы
и зажгите его
от пламени
спиртовки.
Как горит
сера на
воздухе?
-
Внесите
горящую серу
в колбу с
кислородом.
Как она
теперь горит?
 Сжигание серы в
кислороде Сжигание серы в
кислороде
 Внимание!
Опыт
проводится в
вытяжном
шкафу. При
отсутствии
тяги ложку
можно
вставить в
полиэтиленовую
крышку,
которой
закрыть
колбу с
горящей
серой. Внимание!
Опыт
проводится в
вытяжном
шкафу. При
отсутствии
тяги ложку
можно
вставить в
полиэтиленовую
крышку,
которой
закрыть
колбу с
горящей
серой.
Опыт 4.
Горение
железа в
кислороде
-
На дно
стеклянной
банки
емкостью не
менее 500 мл
насыпьте
сухого песка,
наполните ее
кислородом и
накройте
стеклянной
пластинкой.
-
Для
сжигания
приготовьте
спираль из
тонкой
стальной
проволоки (например,
балалаечной
струны), один
конец
которой
прикрепите к
металлическому
стержню, а на
другой -
насадите
небольшую
лучинку (например,
половину
спички).
-
Зажгите
лучинку на
спиртовке и,
когда она
хорошо
разгорится,
внесите
спираль в
сосуд с
кислородом.
Железо
начнет
энергично
гореть,
разбрасывая
раскаленные
частицы.
Банка
заполняется
бурым дымом
оксидов
железа,
хорошо
заметным на
фоне белого
экрана
 Горение железа в кислороде Горение железа в кислороде
Демонстрационно
в кислороде
можно сжечь и
другие
простые и
сложные
вещества -
магний,
фосфор, натрий,
парафиновую
свечу и т.д.
 Горение фосфора в кислороде Горение фосфора в кислороде
После
сжигания в
сосуды надо
приливать
понемногу
дистиллированную
воду,
встряхнуть
их и
исследовать
растворы
индикаторами.
Опыт 5.
Установление
состава
воздуха
-
Стеклянный
колокол,
размеченный
на пять
равных
частей
вливанием
одного и того
же объема
воды,
поместите в
чашу с водой.
Долейте воду
до первого
деления.
-
В железную
ложку,
стержень
которой
пропущен
через
резиновую
пробку,
поместите
немного
красного
фосфора.
-
Зажгите
фосфор на
спиртовке и
быстро
внесите
ложку в
колокол,
плотно
закрыв его
горло.
-
Наблюдайте
за
происходящими
явлениями.
Через 10-15 мин
вода в
колоколе
поднимется
примерно на 1/5
его объема.
Долейте в
чашу воды до
того уровня,
который
образовался
внутри
колокола, и
откройте
пробку.
Исследуйте
горящей
лучиной
оставшийся в
колоколе газ. 
Почему в нем
гаснет
лучина?
 Установление
состава воздуха Установление
состава воздуха
Опыт 6.
Получение
озона
Прибор
для
получения
озона
называется
озонатор.
Школьные
озонаторы,
применявшиеся
до недавнего
времени,
сняты с
производства.
Приборы,
сохранившиеся
в химических
кабинетах,
используются
в качестве
модели.
Применяя
высоковольтный
индуктор "Разряд-1",
можно
провести
опыт
получения
озона в
самодельном
озонаторе,
устройство
которого
схематически
приведено на
рисунке:
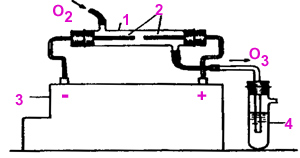 |
1 - трубка-реактор
2 - электроды
3 - высоковольтный
индуктор
4 - пробирка с
йодкрахмальным раствором
|
-
Соберите
установку
согласно рисунку
-
Не приводя
в действие
индуктор,
пропустите
через
озонатор
кислород из
газометра. В
сосуде с
йодкрахмальным
раствором
никаких
изменений не
наблюдается.
-
Включите
индуктор и
продолжайте
пропускать
кислород. Под
действием
электрических
разрядов
кислород
частично
превращается
в озон:
3O2
R
2O3
Йодкрахмальный
раствор
окрашивается
в синий цвет,
так как озон
окисляет
ионы йода I до
свободного
йода I2:
2KI +
O3 + H2O
R
2KOH + O2 + I2
Опыт 7.
Получение
озона с
помощью
электрофорной
машины (по В.Г.
Прокопенко)
К одному из
кондукторов
электрофорной
машины
прикрепите
отрезок
железной
проволоки с
заостренным
концом. На
другой
кондуктор
пластилином
прилепите
пластиковый
экран
размером 2 х 2
см, а на него -
листок
фильтровальной
бумаги,
смоченный
насыщенным
раствором
йодида калия.
Между иглой и
экраном
установите
расстояние в
1-2 см и
приведите
машину в
движение.
Образующийся
вследствие
электрических
разрядов
озон
окисляет
йодид калия,
на листке
бумаги
появляется
бурое пятно
йода.
Ощущается
запах озона.
|



